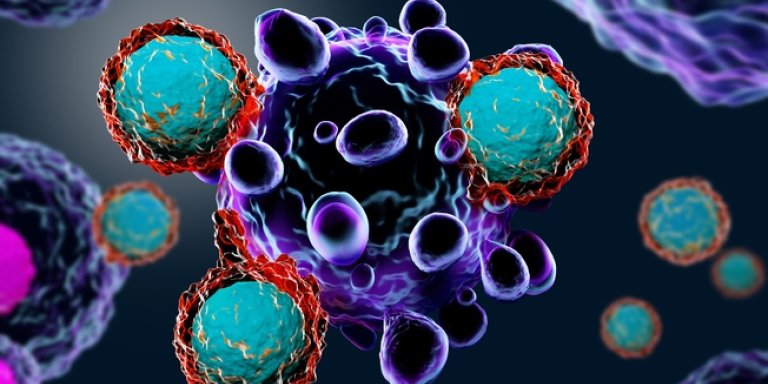
Idealiter kunnen onze eigen afweercellen slechte cellen in ons lichaam de baas. Maar bij (onder andere) lymfeklierkanker werkt dat niet zo. Het lijkt erop dat onze T-cellen, afweercellen die in het bloed zitten, de kankercellen niet herkennen als zijnde kwaadaardig. Ook lijkt het wel of de werking van T-cellen wordt geremd door de kankercellen. Daardoor kunnen die ongestoord hun gang gaan.
Om het eigen afweersysteem van patiënten met kanker een functionele oppepper te geven, is immuuntherapie ontwikkeld. Het principe: stel nou dat je die T-cellen zou kunnen ‘opladen’. Hun antennes versterken, waardoor je het afweersysteem beter bewapent. Daardoor ‘zien’ de T-cellen de kankercellen wél en kunnen ze deze cellen vernietigen. Volgens dit principe werkt CAR-T-celtherapie tegen een aantal vormen van kanker, zoals kanker van het bloed en van de lymfeklieren.
Verrassend goede resultaten
Amsterdam UMC was het eerste ziekenhuis waar CAR-T-celtherapie werd toegepast; inmiddels gebeurt dat ook in andere academische ziekenhuizen en het Utrechtse Prinses Máximacentrum. Vooralsnog alleen bij uitbehandelde patiënten: mensen met een aantal vormen van kanker bij wie bestraling en chemotherapie geen optie meer zijn, en die fit genoeg zijn om deze zware therapie te ondergaan. De behandeling is deels nog experimenteel en extreem prijzig. Maar ze heeft wel de toekomst. Amsterdam UMC heeft inmiddels zo’n 45 patiënten met lymfeklierkanker behandeld. De resultaten zijn verrassend goed: na ruim twee jaar is meer dan de helft nog in leven. De verwachting is dat landelijk jaarlijks uiteindelijk 150 uitbehandelde patiënten met lymfeklierkanker in aanmerking komen voor de behandeling met CAR-T-cellen.
Kwaliteit van leven
Hoogleraar Hematologie Marie José Kersten sleepte eind 2020 voor Amsterdam UMC twee CAR-T-gerelateerde subsidies in de wacht, elk goed voor zo’n 500.000 euro. Daarnaast kreeg een consortium van UMC Groningen, Amsterdam UMC, RadboudUMC en Erasmus MC 30 miljoen euro subsidie van Zorginstituut Nederland en onderzoeksfinancier ZonMw. De academische centra willen daarmee een studie doen waarin zelfgeproduceerde CAR-T-cellen worden vergeleken met commercieel gemaakte. Nu wordt namelijk een Amerikaans farmaceutisch bedrijf ingeschakeld om de T-cellen te bewerken. Mede daardoor kost de behandeling per patiënt in totaal ongeveer 450.000 euro. Bovendien kost die omweg mensenlevens: het duurt zo’n zes weken voordat de gewijzigde afweercellen terug zijn en aan de patiënt kunnen worden gegeven. Sommige patiënten redden dat niet.
Onlangs heeft farmaceut Kite/Gilead een productiefaciliteit geopend in Hoofddorp, van waaruit het bedrijf alle Europese patiënten wil voorzien van CAR-T-cellen. Even duur, maar met tijdwinst.

Hoogleraar Hematologie Marie José Kersten
Het Groningse consortium heeft een hoog gekwalificeerd laboratorium ingericht om de cellen te bewerken. Veel patiënten die voor de therapie in aanmerking komen, kunnen de CAR-T-cellen daardoor na uiterlijk vijftien dagen terugkrijgen. En waarschijnlijk een stuk goedkoper. Wanneer tijd en kosten verminderen, wordt deze aanpak voor meer patiënten toegankelijk.
Hematoloog Kersten maakt deel uit van het Groningse consortium, en is voortrekker van de beide andere gesubsidieerde projecten; Europese projecten waarbinnen zij verantwoordelijk is voor het Amsterdam UMC-aandeel. Voor het project Qualitop ontving Kersten een Horizon2020 subsidie. “Qualitop onderzoekt de impact van het CAR-T-behandeltraject op de patiënten en hun naasten. Hoe ervaren ze de therapie en hoe is de kwaliteit van leven daarna?” Je kunt iemand namelijk wel een zware behandeling laten ondergaan, maar de vraag is wat dit met een mens doet.
Afweer op hol
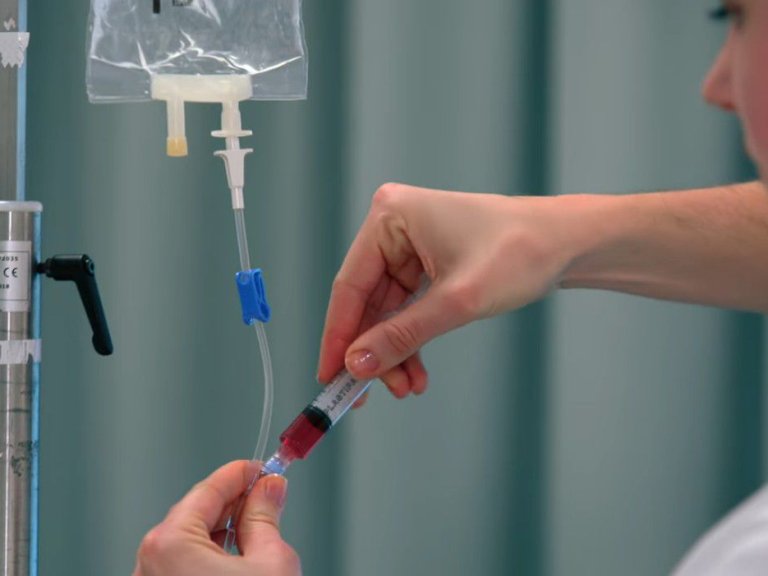
Bij de start van de CAR-T-celtherapie wordt met behulp van een uitgaand en een ingaand infuus het bloed van de patiënt rondgepompt via een zogeheten ‘ferese’-apparaat. In dat apparaat wordt het bloed buiten het lichaam ‘gecentrifugeerd’: het wordt gescheiden in witte bloedcellen (waaronder T-cellen) enerzijds, en plasma, rode bloedcellen en bloedplaatjes anderzijds. Om zo veel mogelijk T-cellen aan het bloed te onttrekken, wordt dit proces een aantal keer herhaald. Deze behandeling heet leukaferese, duurt zo’n vier uur en wordt poliklinisch uitgevoerd.
De zo geoogste T-cellen worden nu ingevroren en overgevlogen naar de Amerikaanse farmaceut die de technologie in huis heeft om T-cellen te versterken tot CAR-T-cellen. Na bewerking worden ze opnieuw ingevroren en teruggestuurd naar Amsterdam UMC. Ter voorbereiding op de teruggave van de cellen krijgt de patiënt drie dagen chemotherapie, gevolgd door twee dagen rust. Dit is nodig omdat de patiënt de bewerkte cellen anders afstoot: het DNA ervan is veranderd, met een afweerreactie als gevolg. Na die vijf dagen worden de CAR-T-cellen ontdooid en via een infuus aan de patiënt teruggegeven.
Dit hele proces neemt al gauw een week of zes in beslag. Kersten: “Vaak hebben de patiënten in die periode overbruggings-chemo nodig om ze stabiel te houden.”
Kersten: “Op dit moment komen buiten studieverband twee groepen patiënten in aanmerking voor CAR-T-celtherapie. Patiënten tot 25 jaar met acute lymfatische leukemie (ALL). Dat gaat om twintig tot dertig mensen per jaar. En patiënten met agressieve lymfeklierkanker, dat zijn er in Nederland 120 tot 150 per jaar.”
Patiënten moeten relatief fit zijn, want ze krijgen het behoorlijk zwaar te verduren. Kersten: “Als je de geactiveerde cellen teruggeeft, slaat het hele afweersysteem op hol. Patiënten krijgen hoge koorts, lage bloeddruk, soms ademhalingsproblemen. Mensen kunnen tijdelijk verward of suf raken. Ze kunnen bijvoorbeeld opeens niet meer praten of krijgen uitvalsverschijnselen. Het is mogelijk dat patiënten daardoor na afloop van de behandeling psychische bijverschijnselen krijgen, zoals angstgevoelens. En ze zijn langdurig erg vatbaar voor infecties.” De Horizon2020-subsidie is bedoeld voor onderzoek naar de kwaliteit van leven van CAR T-celtherapiepatiënten.
Sneller beschikbaar maken
Het andere project waarvoor Kersten subsidie krijgt, is het Europese samenwerkingsverband T2Evolve, spreek uit als Time To Evolve. Dat project, op kosten van het European Union’s Innovative Medicines Initiative (IMI), ging begin februari van start. Hierin werkt Kersten onder andere samen met hoogleraar Hematologie Arnon Kater – die ook enkele andere grote beurzen heeft gekregen op CAR-T-celgebied.
T2Evolve kent meerdere doelen, met bijbehorende teams. Eén team zal heldere en eerlijke voorlichting gaan ontwikkelen. Kersten is vooral bezig met dit gedeelte. Ze wil dat patiënten, hun omgeving en behandelend artsen goed worden geïnformeerd. Zodat ze weten waar ze aan beginnen en wat ze voor, tijdens en na de behandeling kunnen verwachten. “CAR-T-celtherapie werkt niet bij iedereen: slechts veertig procent van de behandelde patiënten heeft er langdurig baat bij. We willen materialen ontwikkelen die de patiënt ondersteunen tijdens het hele traject dat ze afleggen. Juist de stem van patiënt en mantelzorger nemen we hierin mee: wat is er nodig om hen beter te kunnen begeleiden tijdens die ‘reis’? Daarnaast gaan we patiënten volgen tijdens het traject: hoe gaat het met ze? Verder brengen we de beschikbaarheid van de behandeling in Europa in kaart en proberen we de therapie voor méér patiënten toegankelijk te maken.”

Maria Thelemi
Een ander project binnen T2Evolve wil CAR-T-celtherapie sneller beschikbaar maken voor méér Europese patiënten. In dat project werken onder anderen hoogleraar Immuuntherapie van bloedkanker Tuna Mutis, en onderzoeker en universitair docent Maria Themeli. Hun onderzoeksgroep is gespecialiseerd in de behandeling van multipel myeloom (ziekte van Kahler). Amsterdam UMC is expert op dit gebied. Multipel myeloom is een kwaadaardige aandoening die begint in het beenmerg. Daar woekeren plasmacellen, waardoor ze de aanmaak van gezonde bloedcellen in het beenmerg hinderen. Er lopen inmiddels twee studies naar het toepassen van CAR-T-cel therapie bij deze ziekte.
Zelf T-cellen bewerken
Mutis: “Wij werken niet in een research-lab, maar in een productiefaciliteit. In hoogwaardige clean-rooms maken we producten voor patiënten.”Themeli: “Zo maken we T-cellen die het CAR-eiwit op het oppervlak hebben, waardoor ze kanker herkennen. Dit proces van cellen maken proberen we te verbeteren. Hiervoor ontwikkelen we systemen om de veiligheid van CAR-T-cellen te onderzoeken. Een onderdeel is de effectiviteit van die bewerkte cel. Die willen we op verschillende manieren bekijken: is de cel in goede conditie? Wat maakt dat zo’n cel naar behoren werkt? In muismodellen willen we onderzoeken wanneer T-cellen goed functioneren in de tumor-omgeving: dat is anders dan in het lab.”
In samenwerking met de hematologen onderzoeken Mutis en Themeli het verband tussen patiënten en de diverse vormen van kanker: patiënten met verschillende ziektes reageren verschillend op de therapie. Is er een verband tussen de eigenschappen van de ziekte en het wel of niet werken van de behandeling? Kun je aan de hand daarvan voorspellen of het product wel of niet zal werken bij een patiënt?
Zelf ontwikkelen
Mutis breekt een lans voor het zelf bewerken van T-cellen. “In feite kunnen we dit al. We hebben een CAR gemaakt waarmee patiënten met multipel myeloom behandeld zouden kunnen worden.” Maar voor het koppelen van een CAR-eiwit aan een T-cel is een specifiek virus nodig, en dat virus hebben de onderzoekers niet zelf in huis. Mutis zou het graag van de betrokken farmaceut kopen. Hij werkt daarom samen met andere Nederlandse universiteiten aan een nieuwe subsidieaanvraag. Als het lukt het virus te verwerven, kan het ziekenhuis een grote stap zetten in het zelf ontwikkelen van CAR-T-cellen.
De extreem hoge kosten voor CAR-T-cel therapie, aldus Mutis en Themeli, ontstaan mede doordat dit ‘medicijn’ persoonsgebonden is. Voor elke patiënt moet de hele therapie van begin tot eind individueel worden ontwikkeld. Het zou een grote stap voorwaarts zijn als je de bewerking zo zou kunnen standaardiseren dat die beschikbaar wordt voor een brede groep patiënten. Mutis: “Deze therapie wordt op den duur goedkoper; zoals alles in de geneeskunde. Waar wij naar streven is een kant-en-klaar medicijn.” Maar dat is toekomstmuziek.
Tekst: Mieke Zijlmans
Meer lezen?
Lees het verhaal van patiënt Jonathan Clark
Deze tekst verscheen in het juninummer van ons populair-wetenschappelijke blad Janus.